
Biopelículas
Una biopelícula (biofilm) es una población de células que crecen en una superficie inherente o un tejido vivo y se encapsulan en una matriz de exopolisacáridos. Las biopelículas son notoriamente difíciles de erradicar y son fuente de muchas infecciones recalcitrantes.
La composición de la biopelícula es variable en función del sistema, sin embargo, se ha demostrado que solo el 15% son bacterias y que el 85% restante es la matriz extracelular (exopolisacaridos). Existen también unos canales por donde circula agua, enzimas y nutrientes hasta las zonas más interiores de la biopelícula, como también transportan los residuos que generan los microorganismos residentes de la biopelícula. Aún la existencia de estos canales, en el interior se genera una heterogeneidad del estado fisiológico en el que se encuentra la bacteria, la concentración de nutrientes, oxígeno o el pH es distinta en el interior de la biopelícula es distinta al exterior, por lo que dificulta su estudio. [22] [23]

Micrografía electrónica de barrido de un biofilm sobre una superficie metálica de un sistema de agua industrial. [24]
Etapas de crecimiento:

1.- Etapa de fijación inicial: los microorganismos libres se ponen en contacto con la superficie a la que se van a adherir.
2.- Etapa de fijación irreversible: Una pequeña parte de la población bacteriana se adhiere al sustrato. Las bacterias empiezan a sufrir cambios morfológicos.
3.- Etapa de maduración I: Se da la agregación celular y aumenta el número de bacterias.
4.- Etapa de maduración II: La biopelícula crece desde el interior, dándose la división celular de las células que lo forman.
5.- Etapa de dispersión: La colonia de bacterias empieza a desprenderse de la biopelícula formada y estas retornan a su estado libre (planctónico) para continuar promoviendo la infección. [25]
Enfermedades, resistencias y tratamiento de las biopelículas
Se ha visto que las biopelículas están implicadas en una amplia variedad de infecciones microbianas en el cuerpo. Los procesos infecciosos en los que las biopelículas se ven implicadas, incluyen problemas tan comunes como la vaginosis bacteriana, las infecciones del tracto urinario, infecciones por catéter, infecciones del oído medio y la formación de la placa dental [26]. Aunque también están involucradas en procesos menos frecuentes pero más letales, como la endocarditis y infecciones en la fibrosis quística.
Aparte, hay que tener en cuenta que las biopelículas moran en diferentes superficies, ya puede ser en tuberías de agua o bioreactores (esto plantea serios problemas en el ámbito industrial) o en material médico que vaya a usarse para realizar operaciones quirúrgicas. Resulta interesante pues, idear nuevos materiales en los no sea posible la vida de la biopelícula.

Micrografía electrónica de barrido de una biopelícula nativa que se desarrolló sobre una superficie de acero en un período de 8 semanas en un sistema de agua industrial. [24]
Como característica intrínseca de las biopelículas, generan unos gradientes de nutrientes y oxígeno desde la parte superior a la parte inferior de la biopelícula. Estos gradientes se asocian con una disminución de la actividad metabólica bacteriana y un aumento de los tiempos de duplicación de las células bacterianas; son pues, estas células más o menos latentes las responsables de la tolerancia a algunos antibióticos. El crecimiento de biopelículas también se asocia a un mayor nivel de mutaciones, así como una mayor cantidad de mecanismos regulatorios de percepción (quórum). Los mecanismos convencionales de resistencia tales como el cromosómico β-lactamasa, las bombas de flujo y las mutaciones en moléculas diana de antibióticos en bacterias, también contribuyen a la supervivencia de las biopelículas. [27]
Las biopelículas pueden prevenirse mediante la profilaxis antibiótica agresiva. Una estrategia prometedora puede ser el uso de enzimas que disuelvan la matriz de la biopelícula (por ejemplo, DNasa y alginato liasa), así como inhibidores de la detección de quórum que aumentan la susceptibilidad de la biopelícula a los antibióticos. [28]
Investigaciones recientes y aplicaciones
Hay dos maneras de tratar con las biopelículas. Pensando en tratamientos contra la integridad de la biopelícula, ya sea de lisis o aglutinación de las bacterias que lo forman, o atacando contra su matriz extracelular, actuando con antibióticos o péptidos antimicrobianos. O idear tratamientos preventivos, como por ejemplo creando superficies que eviten la adherencia de las biopelículas.
Tratamiento contra la itegridad de la biopelícula
Los biofilms hacen mucho más resistentes las infecciones bacterianas, por lo que desarrollar proteínas o péptidos antibiopelículas, es un área prioritaria en la biomedicina. En especial, se ha trabajado muy recientemente con las catelicidinas (péptidos antimicrobianos). Este péptido tiene un importante efecto contra los biofilms de Pseudomonas aeruginosa, por lo que se considera prometedor por sus potenciales aplicaciones terapéuticas.
El departamento de Bioquímica de la UAB a desarrollado un péptido derivado de la ECP (Eosinofil Cationic Protein), una RNasa humana que parece ser más eficaz contra los biofilms que el LL-37. Es decir que este péptido aparte de ser eficaz contra la forma plantónica de las bacterias también actúa a nivel de la biopelícula.
Primeramente formaron el péptido de la ECP, reduciendo su tamaño. [29]

Esquema de la creación del péptido ECP(x). [29]
Los resultados fueron muy positivos. Permitieron concluir que la proteína y péptidos ensayados afectan en una forma u otra a la integridad global de la biopelícula, destacando un efecto importante para el péptido ECP(x).
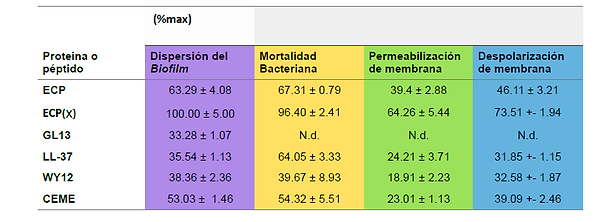
Ensayos de dispersión del biofilm, actividad antibacteriana; permeabilización y despolarización de la membrana de la ECP, ECP(x), GL13 LL-37, WY12 y CEME en %, frente a biofilm formado P. aeruginosa. Se indica los resultados de la mediana ± el error estándar. El % máximo fue calculado a una concentración de 10μM a un tiempo de incubación de 4h. [29]
Tratamientos preventivos
Como se ha comentado anteriormente, un punto crítico es la formación de biofilms en material quirúrgico y en tuberías de agua y de industrias alimentarias. Por lo que se han destinado grandes esfuerzos en el desarrollo de material anti-biopelículas.
En la siguiente tabla realizada por Meng Chen y su grupo [28] se puede comprobar las investigaciones realizadas:

Referencias
^ 22. J. W. Costerton, G. Cheng, T. I. Gersey, J. G. Ladd, M. Nickel. Bacterial biofilms in nature and disease. Annu.Rev.Microbiol (1987); 41:435-64
^ 23. D. E. Caldwell. Cultivación and study of biofilm communites. In H.M. Microbial biofilms (1995); 64-79
^ 24. R.M Donlan, J. W. Costerton. Biofilms: Survival Mechanisms of Clinically Relevant Microorganisms. Clin. Microbiol (2002); 15-2:167-193
^ 25. L. Hall-Stoodley and P. Stoodley. Development regulation of microbial biofilms. Current opinion in biotechnology (2002), 13: 228-233
^ 26. Rogers, Anthony (2008). Molecular Oral Microbiology. Caister Academic Press. p. 88-91
^ 27. N. Høibya, T. Bjarnsholta, M. Givskovb, S. Molinc, O. Ciofu. Antibiotic resistance of bacterial biofilms. International Journal of Antimicrobial Agents (2010); 35: 322–332
^ 28. M. Chen, Q. Yu, H. Sun. Novel Strategies for the Prevention and Treatment of Biofilm Related Infections. Int. J. Mol. Sci. (2013); 14,9:18488-18501
^ 29. D. Velázquez. Estudio de la Proteína Catiónica de Eosinófilos (ECP), como agente antimicrobiano contra biofilms de origen bacteriano. (2014) Tesina. DEPARTAMENTO DE BIOQUÍMICA Y BIOLOGÍA MOLECULAR, Universidad Autónoma de Barcelona.

