
Péptidos antimicrobianos
Los péptidos antimicrobianos son antiguas armas evolutivamente hablando. Su amplia distribución a través de los reinos animal y vegetal sugiere que han cumplido un papel fundamental en la exitosa evolución de organismos multicelulares complejos. Los péptidos antimicrobianos han mantenido su efectividad contra las bacterias, evitando resistencias, dado que actúan sobre una característica de diseño, la membrana celular microbiana, que los distingue de plantas y animales. Los conocimientos que ofrecen esta gran cantidad de investigaciones sobre ellos han dado lugar a un considerable esfuerzo comercial para crear nuevos tipos de terapias anti-infecciosas. [15]

Figura 1: Estructura tridimensional de la RNasa 3 o ECP (Eosinofil Cationic Protein) donde se muestran la diversas regiones implicadas en su actividad [16].
Los péptidos aintimicrobianos suelen tener dos o más aminoácidos cargados positivamente. Estos pueden presentar diferentes estructuras secundarias:
-Los que presentan hélices alfa.
-Los que presentan hoja β por tener 2 o más enlaces disulfuro.
-Los que presentan estructura tipo loop.
-Los que presentan estructura extendida.
Mecanismos de acción de los péptidos antimicrobianos:
Los péptidos y proteínas antimicrobianas actúan principalmente a nivel de la membrana bacteriana, desestabilizándola. Se han propuesto 3 modelos de actuación:

1: Modelo “barrelstave”
En este modelo se propone que los péptidos se insertan en la membrana de manera total, oligomerizan formando un canal y acaban por desestabilizar la célula de manera no saturable.
2: modelo “carpet-like”
En este caso los péptidos se sitúan sobre la membrana y generan la desestabilización vesiculando la membrana de la bacteria, tal y como actuaría un detergente.
3: Modelo toroidal
Los péptidos se insertan en la membrana, pero de forma parcial, esto genera la creación de poros toroidales que desestabilizaran la membrana de forma saturable
Modelos de actuación de los péptidos antimicrobianos sobre la membrana bacteriana [17]
Se pueden clasificar los péptidos antimicrobianos por su origen, pero aquí nos basaremos en los péptidos humanos, centrándonos en dos importantes ejemplos, las ribonucleasas humanas y las catelicidinas.
Ribonucleasas humanas
Las ribonucleasas (RNasas) son enzimas que tienen como función hidrolizar el RNA. En este caso nos centraremos en las RNasas antimicrobianas. Son pequeñas proteínas catiónicas pertenecientes a la superfamilia de RNasas A de los vertebrados. Estas tienen gran variedad de actividad antipatogénica, tales como la agregación de los microorganismos para facilitar su eliminación, la degradación del RNA, la despolarización de las células, entre otras. Las RNasas humanas de la superfamilia A descritas son:

Entre RNasas, la identidad de secuencia en algunos casos es del 30% (figura 2), sin embargo, todas comparten una estructura tridimensional global común y tienen de tres a cuatro enlaces disulfuro conservados. También contienen una tríada catalítica conservada que contiene dos histidinas. También se puede encontrar una región causante de la agregación y otra que es la responsable de la actividad antimicrobiana. (Figura 1)
Se ha visto que la actividad antimicrobiana de estas proteínas reside en el extremo N-terminal. Se puede comprobar esta actividad generando unos péptidos de 45 aminoácidos del extremo N-terminal de cada RNasa humana, que contendrán dos hélices alfa cada péptido, y haciendo los posteriores ensayos correspondientes.

Figura 2: Alineación de secuencia de las 8 RNasas humanas donde se pueden observar los diferentes residuos, 45 aminoácidos del extremo N-terminal, formadores de los péptidos usados en los ensayos. [16]
Catelicidinas
Son una familia de polipéptidos que se encuentran en los lisosomas de los macrófagos y leucocitos polimorfonucleares. Para nombrar las catelicidinas de humanos nos referimos al péptido LL-37. El LL-37 es una molécula efectora importante para la inmunidad innata en los defectos de la piel y tiene un rol crítico contra la infección de agentes bacterianos. [18]
Las catelicidinas pueden variar en tamaño desde, 12 hasta 80 residuos de aminoácidos. La mayoría de catelicidinas son péptidos lineales 23-37 aminoácidos y se pliegan en α-hélices anfipáticas.
Secuencia de aminoácidos de la LL-37. [19]
Mientras que hay múltiples copias de genes de catelicidina en caballos, cerdos y ovejas, sólo un gen de catelicidina se encuentra en los seres humanos. Curiosamente, este único gen de la catelicidina se puede procesar en diferentes formas de péptidos antimicrobianos. LL-37, la forma más comúnmente estudiada. No sólo tiene función antimicrobiana, sino que también posee otros roles funcionales, tales como la quimiotaxis, la apoptosis, la cicatrización de heridas, la modulación inmune y la metástasis del cáncer.

En el estudio que realizo el grupo de Wang [20] consiguieron estructuras de alta calidad para LL-37. Los dos dominios hidrófobos de la hélice anfipática (residuos 2-31) de LL-37 están separados por una residuo hidrófilo esto explica su cooperativa unión con los lipopolisacáridos bacterianos (LPS). En la hélice central (esencial para la actuación contra cepas resistentes y biopelículas), la R23 arginina central es de particular importancia en la unión a las membranas bacterianas o ADN. Mapear los roles funcionales de los aminoácidos catiónicos de la región antimicrobiana de la LL-37 proporciona una base para el diseño de péptidos antimicrobianos con propiedades deseadas.
En la imagen se puede ver la estructura de la LL-37 humana donde se aprecia en alta calidad 3D la hélice central de este péptido. En (A) se muestran las tres regiones de LL-37, siendo S9 quien divide la superficie hidrofóbica de la membrana, de la larga hélice anfipática (residuos 2-31), en dos dominios (tal estructura explica la unión cooperativa de LL-37 a LPS). En (B) se muestran las cadenas laterales importantes de la LL-37 que participan directamente en las interacciones de membrana por RMN (resonancia magnética nuclear). Se muestran también los cuatro anillos aromáticos hidrófobos (F5, F6, F17 y F27 en verde), así como el catiónico R23. Sólo la cadena lateral de R23 está cerca de la superficie hidrófoba. Por lo tanto es necesaria para las interacciones de membrana o la unión a otros componentes aniónicos tales como ADN [20].
Investigación en curso y aplicaciones
En la siguiente tabla [21] se pueden observar los péptidos antimicrobianos que están en tratamiento y desarrollo (2013).
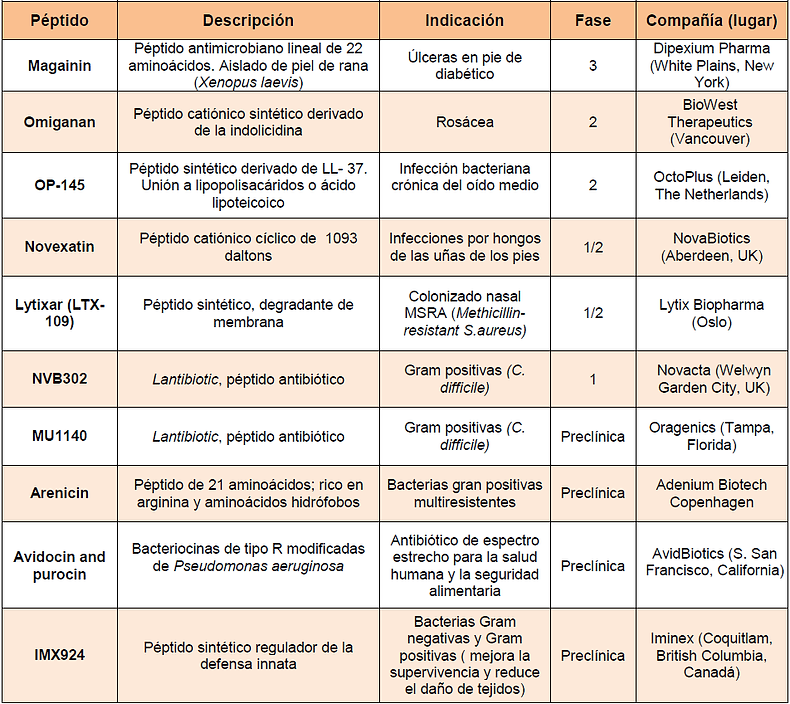
El gobierno federal de EEUU proporciona años adicionales de exclusividad en el mercado de los antimicrobianos, al igual que la FDA (Food and Drug Administration) ha tomado una postura más flexible a la hora de los ensayos clínicos en los últimos años a vista de la importancia de encontrar nuevos antimicrobianos [21]. Gracias a ello, los esfuerzos por llevar péptidos antimicrobianos al mercado se está acelerando.
Referencias
^ 15. H. G. Boman. Peptide antibiotics and their role in innate immunity. Annu. Rev. Immunol (1995); 13:61-92
^ 16. M. Torrent, D. Pulido, J. Valle, M. V. Nogues, D. Andreu and E. Boix. Ribonucleases as a host-defence family: evidence of evolutionarily conserved antimicrobial activity at the N-terminus. Biochem. J. (2013); 456:99–108
^ 17. Z. Oren, Y. Shai. Mode of action of linear amphipathic alpha-helical antimicrobial peptides. Biopolymers (1998); 47:451-63
^ 18. M. Reinholz, T. Ruzicka and J. Schauber. Cathelicidin LL-37: An Antimicrobial Peptide with a Role in Inflammatory Skin Disease. Ann Dermatol (2012); 24,2:126–135
^ 19. G. H. Gudmundsson, B. Agerberth, J. Odeberg, T. Bergman, B. Olsson, R. Salcedo. The human gene FALL39 and processing of the cathelin precursor to the antibacterial peptide LL-37 in granulocytes. European Journal of Biochemistry (1996); 238,2:325-332
^ 20. G. Wang, B. Mishra, R. F. Epand, R. M. Epand. High-quality 3D structures shine light on antibacterial, anti-biofilm and antiviral activities of human cathelicidin LL-37 and its fragments.Biochim Biophys Acta (2014); 1838:2160-72
^ 21. J. L. Fox. Antimicrobial peptides stage a comeback. Nature Biotechnology (2013); 31:379–382

